Indice
QUÉ ES LA CRISTALIZACIÓN
La cristalización es un proceso por el cual, los iones, átomos o moléculas de un gas o de un líquido forman una red cristalina, la unidad básica de un cristal.
QUÉ ES UN CRISTAL
Un cristal se caracteriza principalmente por ser materia ordenada. La materia es ordenada de forma externa, presentando siempre caras planas y brillantes de forma natural, tal y como se puede ver en el cuarzo de esta foto:
Además el orden de los cristales no es solo externo, los cristales tienen un orden interno, que a su vez es responsable de las características de los cristales. Siempre existe en ellos la celda unidad. La celda unidad es un conjunto de átomos que se repite en el espacio. En esta imagen puedes ver el cristal de sal, cloruro de sodio. Es una estructura ordenada de moléculas de NaCl que se repiten.
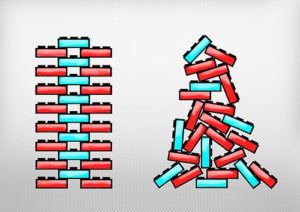
En muchas ocasiones se confunde el vidrio con cristal, es precisamente esta estructura ordenada lo que lo diferencia. El vidrio es amorfo, mientras que un cristal es perfectamente simétrico. Esquemáticamente esta imagen diferenciaría lo que es un vidrio de un cristal. El cristal sería la imagen de la izquierda y el vidrio de la derecha.
CRISTALIZACIÓN EN EL LABORATORIO
Vamos a dejar de lado la cristalización natural que se produce en la naturaleza, donde intervienen más factores de tiempo, presión y temperatura y vamos a ver cómo podemos formar cristales en el laboratorio.
En el laboratorio podemos conseguir de forma muy sencilla cristales de diferentes materiales, donde su solubilidad a temperatura ambiente es mucho menor que a mayor temperatura. De esta forma, se disuelve una cantidad del material saturando la solución a la mayor temperatura, y al irse enfriando y bajando la temperatura la parte no soluble se irá formando en cristales. Cuanta más lento el enfriamiento más grandes los cristales.
PRODUCTOS PARA CRISTALIZACIÓN EN EL LABORATORIO
Algunos productos con los que se puede conseguir cristalización en el laboratorio de forma relativamente sencilla son los siguientes:
Sulfato de Cobre
Alumbre Potásico
Ver cristalización con alumbre potásico
EXPERIMENTOS DE CRISTALIZACIÓN
PROPIEDADES DE LOS CRISTALES
Por su estructura cristalina, con una red cristalina que se repite (ver imagen superior), los cristales tienen estas características comunes:
- Simetría. Los cristales presentan simetría alrededor de algún eje. Un objeto tiene simetría si con él puede efectuarse alguna operación tal que permanezca idéntico a sí mismo. Hay 32 tipos diferentes de simetría en los cristales. Se denominadas las treinta y dos clases de cristales.
- Homogeneidad. La materia cristalina es homogénea, el motivo que se repite es siempre el mismo grupo de átomos.
- Anisotropía. Las propiedades físicas de los cristales no son las mismas en todas las direcciones. Depende del eje de simetría y de la distribución de la red cristalina. Así un cristal puede tener enlaces muy fuertes en una dirección x y débiles en otra dirección.
- Los cristales tienen una difracción de la luz no difusa y bien definida. Esto se explica que al entrar un rayo de luz en un cristal, éste es reflejado de forma muy definida y en haz, sin difundirse.
SABER MÁS
- Propiedades de la cristalización según el compuesto. Cómo afecta la temperatura, presión y humedad en el proceso de cristalización de un elemento.
- Cómo analizar la naturaleza de los cristales: Difracción de Rayos X.