Los enlaces químicos son los procesos responsables de las interacciones entre los átomos y moléculas. Las interacciones entre átomos y moléculas es un proceso tan complejo que entra en juego la física cuántica. En modo sencillo, un enlace químico es la fuerza que existe entre los átomos una vez que se ha formado un sistema estable. Podemos clasificar los enlaces químicos en 3: enlace iónico, enlace covalente y enlace metálico.
Todos los cuerpos que conocemos, desde moléculas, cristales, metales y gases están unidos por enlaces químicos. Son los enlaces químicos los que van a determinar las propiedades tanto físicas como químicas de los objetos. El tipo de enlace entre los átomos y moléculas va a depender principalmente de la estructura atómica, número de electrones y electronegatividad del átomo.
Indice
PORQUÉ SE PRODUCEN LOS ENLACES QUÍMICOS
Los átomos simples no suelen ser elementos químicamente estables (a excepción de los gases nobles). Esto es debido a la cantidad de electrones que tienen los átomos. Los electrones en el átomo se distribuyen en diferentes órbitas (niveles de energía) alrededor del átomo, van completando desde el primer nivel hasta el último que puedan completar. Cada nivel debe tener un número determinado de electrones para considerarse estable. En caso de no completarse el último nivel, el átomo tiende a perder electrones o a coger electrones para crear una estructura estable.
La cantidad de electrones que debe perder o ganar el átomo para completar el último nivel se conoce como número de oxidación o electrones de valencia. El número de oxidación se corresponde al número con el que queda cargado el átomo. Estará cargado positivamente si pierde electrones y negativamente si los tiene que ganar para completar la última capa.
Aunque los enlaces son complejos y deben ser explicados por la teoría cuántica, a través de algunas reglas de simplificación vamos a ver 3 tipos de enlaces: enlace iónico, enlace covalente y enlace metálico.
CLASIFICACIÓN DE ENLACES QUÍMICOS
ENLACE IÓNICO
La base de un enlace iónico es un enlace donde se une un átomo al que le sobran electrones para completar la última capa con otro al que le faltan, de tal forma que ambos átomos quedan completos.
Un enlace iónico también puede darse entre una molécula con carga negativa y un metal (de carga positiva). Sería el caso de los sulfatos, formados por enlaces iónicos del sulfato de distintos metales, y de ahí su solubilidad.
PROPIEDADES DE LOS ENLACES IÓNICOS
Los elementos con enlaces iónicos tienen propiedades comunes que vamos a detallar a continuación:
- Su estado normal es sólido.
- Tienen un elevados puntos de fusión.
- Son solubles en agua u otros disolventes polares.
- En disolución acuosa conducen la corriente eléctrica. En su estado sólido no.
- Es un enlace fuerte que depende de la diferencia de electronegatividad de los elementos que lo forman.
EJEMPLO DE ENLACE IÓNICO
El ejemplo más característico que se da al hablar de enlace iónico es el de la Sal Común, NaCl.
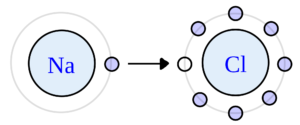
Na: El sodio tiene de valencia 1+, ya que le sobra un electrón para dejar sus capas de electrones completas. Al Cloro, Cl, le falta 1 electrón para completar la tercera capa, tiene de valencia 1-. En el enlace NaCl, el sodio le cede un electrón al cloro y el cloro gana ese electrón. Ambos átomos quedan por tanto estables formando un enlace iónico. Ver más ejemplos de enlaces iónicos.
ENLACES COVALENTES
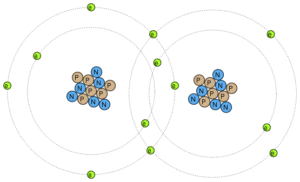
El enlace covalente es un tipo de enlace químico que se da entre 2 átomos cuando estos comparten electrones para completar el último nivel.
Cuando la diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca un enlace iónico. Para que se produzca un enlace covalente es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7. Ampliar información sobre el enlace covalente.
DISTRIBUCIÓN DE LOS ELECTRONES EN EL ÁTOMO
Siempre que hablamos de enlaces químicos aparecen los téminos de capa de valencia, electrones de valencia, regla del octeto, número de oxidación. Todos estos términos están relacionados entre si. Vamos a ver a qué se refiere cada uno de ellos para poder entender bien los enlaces químicos entre elementos de la tabla periódica.
NÚMERO DE OXIDACIÓN. CAPA Y ELECTRONES DE VALENCIA
Los electrones en un átomo se distribuyen en diferentes capas por niveles de energía. A medida que se va completando cada capa pasa a la segunda. En el primer nivel, o primera órbita puede haber hasta 2 electrones, en el segundo 8, en el tercero 18, en el cuarto 32. Las diferentes capas donde se situan los electrones están ordenadas de la siguiente forma.
El número de electrones que tiene un átomo es igual al número de protones, y esto corresponde con el número atómico. El número atómico te lo da la posición en el que está el elemento en la tabla periódica.
REGLA DEL OCTETO
Un átomo es estable cuanto más completa tiene cada órbita de electrones. En el momento que le faltan electrones, o sobran, para dejar la última capa completa, va a tender a perderlos o ganarlos. Si tiene 7 electrones en la segunda capa, va a tender a ganar uno, por tanto gana 1 electrón o, lo que es lo mismo, una carga negativa. Se quedará en un estado de oxidación -1. Este el número de oxidación o valencia de un átomo. Puedes ver más detalle en números de oxidación. Esto es conocido como regla del octeto o ley de Lewis.
Los gases nobles son los elementos que no reaccionan o comparten con nadie porque ya tienen su última capa completa y de ahí su estabilidad y baja reactividad. Se trata de la tendencia que evidencian los átomos de completar su nivel energético con ocho electrones para alcanzar estabilidad.
El científico estadounidense Gilbert Newton Lewis fue quien, en 1917, postuló la regla de octeto. Lewis advirtió que, al combinarse entre sí, los átomos intentan lograr la configuración estructural que tiene el gas nobleubicado más cerca en la tabla periódica de elementos.
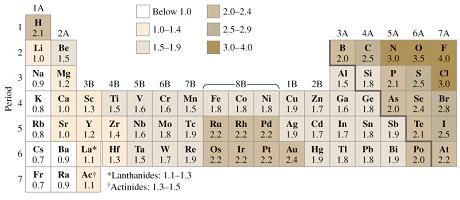
ELECTRONEGATIVIDAD
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su capacidad para atraerlos. Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado, atraerá electrones de otros átomos y además se resistirá a dejar ir sus electrones ante atracciones externas; será muy electronegativo.
Los compuestos formados por elementos con electronegatividades muy diferentes tienden a formar enlaces iónicos. Para que se de un enlace covalente entre 2 átomos la diferencia de electronegatividad debe ser menos de 1,7.
FUERZAS DE VAN DER WAALS
Las fuerzas de van der Waals son fuerzas de estabilización molecular (dan estabilidad a la unión entre varias moléculas), también conocidas como atracciones intermoleculares o de largo alcance y son las fuerzas entre moléculas(fuerzas entre molecula-molecula).
Son fuerzas mas débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
Para tener una idea de la poca fuerza que tienen, si un enlace covalente tuviera una fuerza de 100, las de Van der Waals serían de valor 1 (100 veces menor).
De hecho las fuerzas de van der Waals son las fuerzas atractivas o repulsivas entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas a un enlace (covalente, iónico o metálico). Incluyen a atracciones entre átomos, moléculas y superficies fuera de los enlaces normales.
Antes de explicar cada una de los tipos de fuerzas posibles de Van der Waals es importante conocer que hay moléculas polares y no polares